一株产纤维素酶真菌的筛选及产酶条件优化
1. 国家林业局 生物乙醇研究中心,湖南长沙 410004; 2. 中南林业科技大学 生物环境科学与技术研究所,湖南长沙 410004
Screening and identification of a cellulase-producing fungus and optimization of its fermentation condition
1. Bioethanol Research Center, Ministry of Forestry, Changsha 410004, Hunan, China; 2. Institute of Biological and Environmental Science and Technology, Central South University of Forestry and Technology, Changsha 410004, Hunan, China
cellulase; fungus; screening and identification; optimum of fermentation condition
作者简介:陆 晨(1986—),男,湖南株洲人,硕士研究生,生物化学与分子生物学专业;E-mail:theonlyshark32@sina.com 通讯作者:陈介南(1961—), 男,博士,教授,博士生导师,E-mail:jchen2002@yahoo.com
-
利用羧甲基纤维素钠培养法、刚果红染色法、滤纸崩解法和胞外纤维素酶活性测定法,从湖北神农架保护区不同区域采集的森林腐质土壤中分离筛选得到一株高产纤维素酶的真菌B-5。结合菌落形态观察、显微镜观察和ITS 序列同源性分析,确定该菌株为镰刀菌属Fusarium,与木贼镰刀菌Fusarium equiseti 相似度达99%。滤纸崩解实验显示该菌72 h 对滤纸具有明显崩解能力,失重率达37.9%。以羧甲基纤维素钠为碳源,蛋白胨为氮源,28℃,180 r/min, 培养5 d,初始酶活为FPA 酶活(FPase) 2.09 IU/mL,CMC 酶活(CMCase)5.20IU/mL。通过产酶条件优化,确定稻草为唯一碳源,初始pH 为6.1,氮源浓度为1.0%,碳源浓度为2.5%,鼠李糖脂添加量为0.1%,FPA 酶活达2.205 IU/mL,相应CMC 酶活为5.174 IU/mL。
An effective cellulase-producing fungus named B-5 was isolated from the primary forest soil in different regions of theprotected area in Shennongjia, Hubei, China, by using the methods of CMC-Na culture medium, Congo red staining, disintegrationof filter paper and measurement of enzymatic activity of cellulose. The strain was identified as Fusarium by observing its colonymorphology and microscopic characteristics as well as ITS sequence homology analysis, having the similarity of 99% with Fusariumequiseti. The filter disintegration experiments show that the fungus had strong capacity of filter decomposition in within 72 hours and theweight loss rate reached 37.9%. By taking CMC-Na as the carbon source, peptone as nitrogen source, 28 ℃ , 180 r/min, cultured 5 days,the initial activity were FPAase of 2.09 IU/mL, CMCase of 5.20 IU/mL. After optimization of fermentation conditions, by taking ricestraw as the sole carbon source, initial pH of 6.1, 1.0%, nitrogen concentration 0.1%, carbon concentration 2.5%, rhamnolipid addition0.1%, the FPAase reached 2.205 IU/mL, the corresponding CMCase was 5.174 IU/mL.
引言
木质纤维是自然界最丰富的可再生资源,占整个植物细胞干重的90% 以上。不同植物中木质纤维各种组分的含量是不同的,软木中的木质素含量比硬木高,草中的纤维素含量最高。一般来说,木质纤维素中含纤维素45%、半纤维素30% 和木质素25%[1]。其中含量最高的纤维素必须通过纤维素酶的作用分解成还原糖的形式方可用于乙醇发酵等领域[2]。然而,就目前国内外研究现状,纤维素酶活力不高是限制木质纤维资源利用的主要因素[3],所以选育高产纤维素酶的菌种是关键所在。产纤维素酶的生物种群十分广泛,如细菌、真菌、放线菌及昆虫、软体动物和原生动物等,而目前主要是利用细菌、真菌和放线菌等微生物发酵来获得纤维素酶[4]。细菌类包括纤维黏菌属、纤维杆菌属和芽孢杆菌属等;放线菌包括链霉属、高温放线菌属和弯曲热单胞菌等;真菌类包括木霉属、曲霉属、青霉属、漆斑霉属、孢霉属等[5]。本研究从自然界筛选得到一株高产纤维素酶的真菌,经鉴定为镰刀菌属,拓宽了产纤维素酶的真菌属种,为木质纤维的降解提供了参考。
1 材料与方法
1.1 实验材料
1.1.1 样品
采集地点为湖北省神农架保护区,具体采样地点包括大龙潭、鸭子口、板壁岩等地,样品均为森林腐质土壤。稻草粉,收集长沙县脱谷稻草秸秆,剪成3 cm 片段,烘干后用微型植物粉碎机粉碎至30 ~ 120 目。
1.1.2 培养基
① CMC-Na 培养基:CMC-Na 15 g,NH4NO31 g, 酵母膏1 g,MgSO4·7H2O 0.5 g,KH2PO4 1 g,去离子H2O 1 000 mL,琼脂2%,pH 自然。②刚果红纤维素鉴定培养基:(NH4)2SO4 0.2%,MgSO4·7H2O 0.05%,K2HPO4 0.1 %,NaCl 0.05%,CMCNa2.0%g,刚果红0.02%,琼脂2.0%,pH 自然。③滤纸液体培养基:滤纸2 g,NH4NO3 1 g,酵母膏1 g,MgSO4·7H2O 0.5 g,KH2PO4 1 g, 去离子H2O 250 ml。④液体产酶鉴定培养基[6]:蛋白胨3 g,酵母膏0.2 g,(NH4)2SO4 2 g,KH2PO4 4 g,CaCl2·2H2O 0.3 g,MgSO4·7H2O 0.3 g,CMC-Na 10 g,去离子H2O 1 000 mL,pH 自然。⑤种子培养基:葡萄糖20 g/L,蛋白胨1 g/L,Mandels 营养盐浓缩液100 ml/L,Mandels 微量元素浓缩液1 ml/L,1 mol 柠檬酸缓冲液50 ml/L。
1.2 分析方法
1.2.1 初筛方法
利用CMC-Na 培养基获得纯菌落,用1 mg/mL 的刚果红溶液染色30 min[7],再用蒸馏水清洗,最后用1 mol/L 的NaCl 溶液脱色30 min。以透明圈的直径和菌落直径的比值大小作为筛选的标准,将筛选到的菌株接种到滤纸液体培养基中,28℃,180 r/min,以不接种任何菌株的滤纸液体培养基作为空白对照,重复3 次实验,以滤纸的失重率(X) 作为筛选的标准,X=(m-m1)/m,其中m为最初滤纸质量,m1 降解后滤纸经烘干后的质量。
1.2.2 复筛方法
将初筛得到的几株菌按5% 的接种量接种到液体产酶培养基中,28℃,180 r/min,振荡培养5 天后,将培养液4 000 r/min 离心10 min,取其上清液测定酶活(FPA 酶活、CMC 酶活)大小。
1.2.3 酶活测定[8]
FPA 酶活: 取四支试管, 将裁剪成50±0.5mg 滤纸条折成M 形沿竖直方向推到试管底部,加入0.05 mol pH4.8 柠檬酸缓冲液1.5 mL,待测酶液0.5 mL(空白管不加),充分混匀后于50℃水浴放置60 min,迅速向各管加入DNS 试剂3 mL,空白管加酶液0.5 mL,沸水浴放置10 min,冷却后定容至25 mL,用空白管调零,540 nm 测定OD值,以吸光度平均值查标准曲线计算还原糖含量。
CMC 酶活: 取4 支试管, 分别加入用0.05mol pH4.8 柠檬酸缓冲液配置的CMC-Na 液2mL,待测酶液0.5 mL(空白管不加),充分混匀后于50℃水浴放置30 min,迅速向各管加入DNS试剂3 mL,空白管加酶液0.5 mL,沸水浴放置10min,冷却后定容至25 mL,用空白管调零,540nm 测定OD 值,以吸光度平均值查标准曲线计算还原糖含量。
上述酶活测定,反应后均用DNS 法测定酶解产生的还原糖量,酶活单位采用国际单位,1 mL酶液1 min 分解底物生成1 μmol 葡萄糖的酶量定义为1 个酶活单位,以IU/mL 表示。
1.2.4 形态鉴定
将菌株接种到PDA 平板上,培养3 天,观察菌落的特征。在平板上挑菌体少许,涂于载玻片上,乳酸石碳酸棉兰染色液染色后置于显微镜下观察(水浸片法),参照《真菌鉴定手册》[9] 进行菌种鉴定。
1.2.5 18SrDNA 序列鉴定
100 mg 菌丝样品于液氮中研磨至粉末,保存于1 mL 离心管中[10]。利用酵母总DNA 提取试剂盒(天根生化科技有限公司)提取菌株总DNA,采用ITS1 (5'-TCCG TAGG TGAA CCTG CGG-3') 和ITS4(5'-TCCT CGCC TTAT TGAT ATGC-3')引物扩增菌株18SrDNA 转录间隔区[11]。PCR反应体系为50 μL,程序为:94℃预变性5 min,94℃变性50 s,51℃退火50 s,72℃延伸2 min,30 个循环,最后72℃延伸10 min。扩增产物经琼脂糖电泳检测后送北京六合华大基因公司测序,于NCBI 数据库Blast 比对分析。
1.2.6 产酶条件的优化
首先进行产酶培养基单因素试验,保持培养基中其他成分不变,分别改变其中的碳源、氮源、初始pH 和表面活性剂(鼠李糖脂)[12] 这4 个因素,筛选出影响B-5 菌株产纤维素酶的最佳单因素。然后设计4 因素3 水平正交试验[13],确定产纤维素酶的最优组合。
2 结果与分析
2.1 初筛结果
利用CMC-Na 培养基分离得到9 株形态不同菌种,有细菌、放线菌和真菌。刚果红染色,均产生大小不一水解圈,其中B-5 菌株水解圈直径与菌落直径比值并不是最大,见图1。将分离得到9 株菌接种到滤纸液体培养基培养3d 后,测定滤纸失重率,其中接种B-5 的培养基中滤纸条被崩解成不规则小片,整个培养基成糊状,见图2,滤纸失重率为最大,达37.9%。
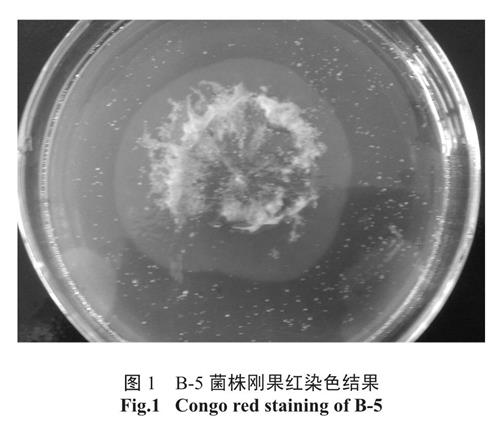
图1 B-5 菌株刚果红染色结果
Fig.1 Congo red staining of B-5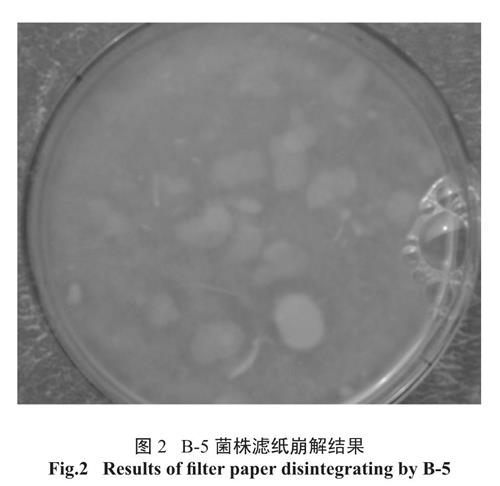
图2 B-5 菌株滤纸崩解结果
Fig.2 Results of filter paper disintegrating by B-52.2 复筛结果
对于以上9 株菌均进行了产酶实验,它们的FPA 酶活和CMC 酶活见表1,可见B-5 的FPA 酶活和CMC 酶活均最高。
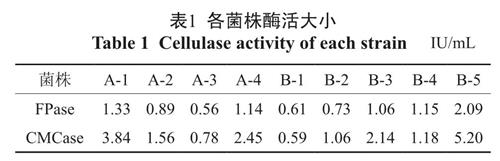
表1 各菌株酶活大小
Table 1 Cellulase activity of each strain IU/mL2.3 形态鉴定
PDA 培养基28℃条件下培养4 天后菌落直径达到3 cm 左右,菌落起初呈粉白色,4℃保藏10天后局部呈淡黄色,见图3。菌落表面附着孢子,绒毛状。显微镜下观察,菌丝缠绕抱团,由单细胞链接而成,见图4。通过菌落和菌丝特征,推测其为一株真菌。
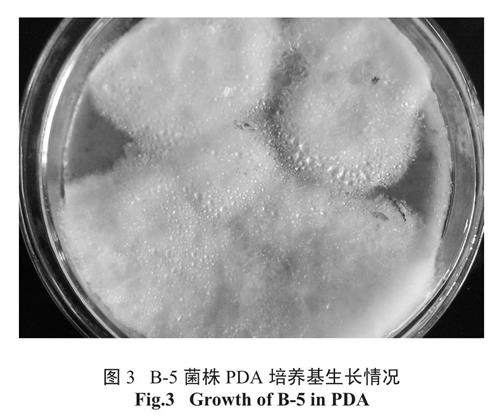
图3 B-5 菌株PDA 培养基生长情况
Fig.3 Growth of B-5 in PDA
图4 B-5 菌株菌丝情况
Fig.4 Microscopic examination of B-5’s hyphae2.4 分子鉴定
获得B-5 菌总DNA 模板后,利用ITS 引物在4 个退火温度梯度下(51℃、53℃、55℃、57℃)进行PCR 反应,均得到目的扩增产物,大小700bp 左右,见图5。测序拼接后登陆Genebank 进行Blast 比对,确定其为镰刀菌属,与木贼镰刀菌同源性达99%。
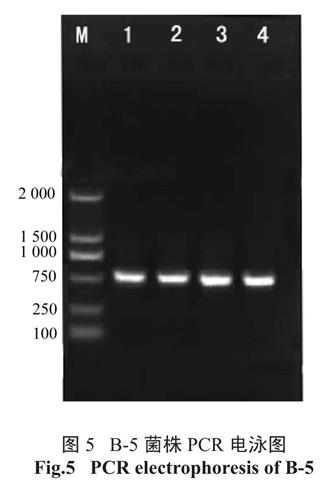
图5 B-5 菌株PCR 电泳图
Fig.5 PCR electrophoresis of B-52.5 B-5 镰刀菌产酶条件的优化
2.5.1 不同碳源对产酶活力的影响
由图6 可见,利用CMC-Na 为唯一碳源时,FPA 酶活和CMC 酶活均最高(2.09 IU/mL 和5.20IU/mL),但稻草秸秆是天然可再生资源,并且作为农业废物利用率较低,在实际应用方面具有优势,故选取稻草作为唯一碳源进行产酶条件优化。
2.5.2 稻草添加量对FPA 酶活力的影响
由图7 可见,当稻草添加量在0.5% ~ 2.5%之间时,随着稻草添加量的增加,酶活不断升高。当稻草添加量为2.5% 时,FPA 酶活最高为1.841IU/mL。
2.5.3 蛋白胨添加量对FPA 酶活力的影响
由图8 可见,当蛋白胨添加量在0.2%~ 0.8%之间时,随着蛋白胨添加量的增加,酶活不断升高。当蛋白胨添加量为0.8%时,酶活最高为1.863 IU/mL。
2.5.4 初始pH 值对FPA 酶活力的影响
保持培养基营养成分不变,当培养基的初始pH 值在酸性环境下逐渐升高时,酶活也不断升高。当初始pH 值为6.1 时FPA 最高为1.875 IU/mL,见图9。
2.5.5 表面活性剂对FPA 酶活力的影响
保持培养基营养成分不变,分别添加0%、0.1%、0.2%、0.3%、0.4%、0.5% 的鼠李糖脂(购买的制剂,鼠李糖脂含量为50% ~ 60%)。当鼠李糖脂添加量为0.1% 时,FPA 酶活最高为2.067IU/mL,见图10。
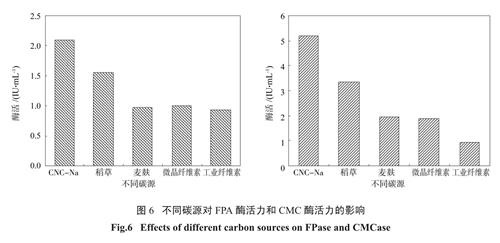
图6 不同碳源对FPA 酶活力和CMC 酶活力的影响
Fig.6 Effects of different carbon sources on FPase and CMCase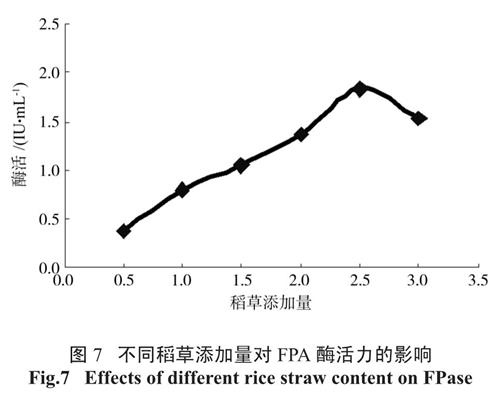
图7 不同稻草添加量对FPA 酶活力的影响
Fig.7 Effects of different rice straw content on FPase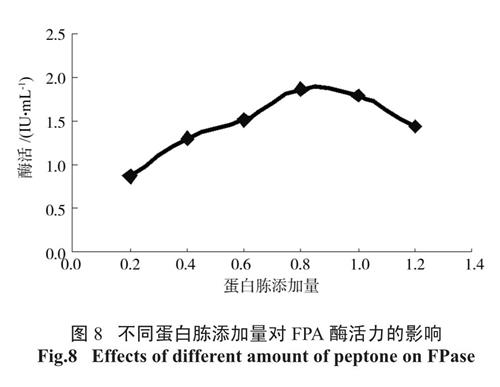
图8 不同蛋白胨添加量对FPA 酶活力的影响
Fig.8 Effects of different amount of peptone on FPase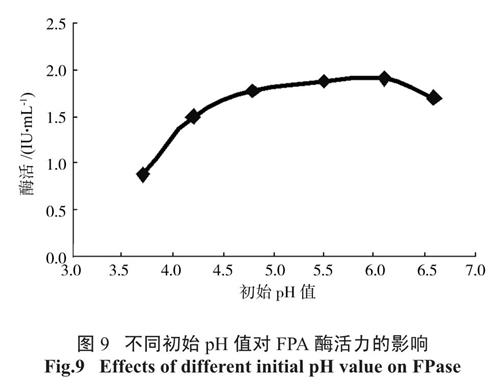
图9 不同初始pH 值对FPA 酶活力的影响
Fig.9 Effects of different initial pH value on FPase2.5.6 产酶培养基优化实验
在以上单因素实验的基础上,选取培养基初始pH、氮源(蛋白胨)、碳源(稻草)和表面活性剂( 鼠李糖脂) 这四个因素作为B-5 镰刀菌产酶过程中培养基优化的因素,设计四因素三水平的正交试验如表2,试验结果见表3。
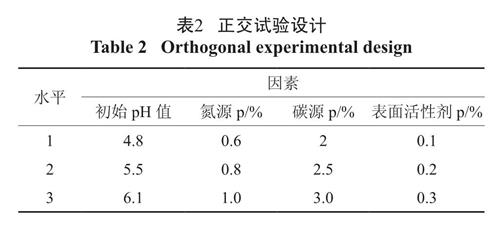
表2 正交试验设计
Table 2 Orthogonal experimental design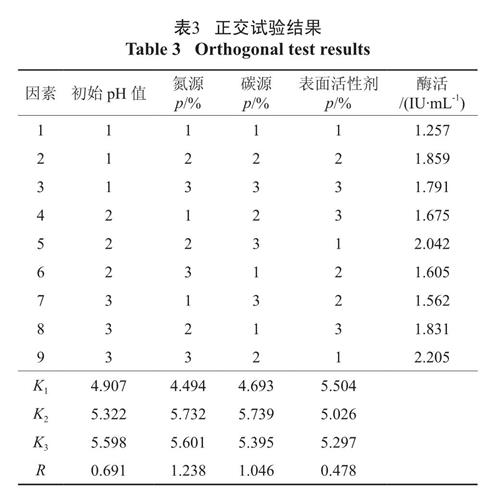
表3 正交试验结果
Table 3 Orthogonal test results各因素对FPA 酶活影响的大小顺序为氮源>碳源> 初始pH 值> 表面活性剂。从试验结果中得出最优组合:初始pH 为6.1,氮源浓度为1.0%,碳源浓度为2.5%,鼠李糖脂添加量为0.1%,酶活最高为2.205 IU/mL。
图10 不同鼠李糖脂添加量对FPA 酶活力的影响
Fig.10 Effects of different rhamnolipid content on FPase
3 结 论
本研究从原始的自然环境采集样品,利用刚果红染色和滤纸崩解等基础方法分离筛选出产纤维素酶的菌种9 株。鉴于细菌、放线菌和真菌的生长形式不同,刚果红染色产生水解圈的大小并不能作为其产纤维素酶活力高低的唯一标准,于是利用滤纸的崩解效率进行反复验证。最后精确测定FPA 酶活和CMC 酶活确定产酶最优的菌种B-5。菌种鉴定时,首先通过观察菌落形态和菌丝结构基本确定其为一株真菌,然后利用酵母总DNA 提取试剂盒提取其总DNA 作为模板,通过ITS1 和ITS4 引物扩增其18SrDNA 转录间隔区,在NCBI 数据库中进行Blast 比对确定其为一株镰刀菌。在产酶优化实验中,将FPA 酶活力(全酶活)大小作为唯一标准,确定最优产酶培养基:稻草粉末25 g/L,蛋白胨10 g/L,KH2PO4 2 g/L,CaCl2·2H2O 0.4 g/L,MgSO4·7H2O 0.02 g/L,Mandels微量元素浓缩液1 mL/L,1 mol 柠檬酸缓冲液50mL/L,鼠李糖脂添加量0.1%,pH 为6.1。FPA 酶活为2.205 IU/mL,相应CMC 酶活为5.174 IU/mL。
镰刀菌通常作为植物甚至农作物的致病菌进行研究[14],在原始森林中筛选出的B-5 镰刀菌具有较高产纤维素酶能力,利用稻草作为碳源时有良好的产纤维素酶效果。虽然酶活离预期还有一段距离[15],但是通过其它的条件优化仍有提高潜力,本研究不仅拓宽了产纤维素酶的菌谱,也为寻求稻草秸秆新的利用途径做出了贡献。
-
参考文献
- [1] Wood W A, Kellogg S T. Cellulose and Hemicellulose[J].Methods in Enzymology. Biomass. Part A, 1988, 160.
- [2] 曲音波. 木质纤维素降解酶系的基础和技术研究进展[J]. 山东大学学报( 理学版),2011, 46(10): 160-171.
- [3] 张华锋. 纤维素酶研究进展[J]. 现代农业科学, 2009,16(6):25-27.
- [4] Duff S J B, Murray W D. Bioconversion of forest products industry waste cellulosics to fuel ethanol: a review[J].Bioresource Technology, 1996, 55: 1-33.
- [5] 魏亚琴,李红玉. 纤维素酶高产菌选育研究进展及未来趋势[J]. 兰州大学学报(自然科学版),2008, 44: 107-115.
- [6] 刘海波,王义强,陈介南,等. 一株高产纤维素酶菌的筛选与鉴定[J]. 生物学杂志,2008,25(3):16-20.
- [7] 叶姜瑜. 快速识别纤维素分解菌的新方法[J]. 生物学通报,1997,32(12): 34.
- [8] 中华人民共和国国家发展和改革委员会[S]. QB 2583-2003.纤维素酶制剂.
- [9] 魏景超. 真菌鉴定手册[M]. 上海:上海科学技术出版社,1979:495 -499.
- [10] 燕 勇,李卫平,高雯洁,等. rDNA-ITS 序列分析在真菌鉴定中的应用[J]. 中国卫生检验杂志,2008, 18(10): 1958-1961.
- [11] Sambrook J, Russell D. Molecular Cloning: A Laboratory Manual, 3rd edn[M]. New York: Cold Spring Harbor Laboratory Press. 2001: 304-331.
- [12] 刘 佳,袁兴中,曾光明,等. 表面活性剂对绿色木霉产纤维素酶影响的实验研究[J]. 中国生物工程杂志,2006, 26(8):62-66.
- [13] 杜先林,李 辉,王义强,等. 里氏木霉Rut—30 产纤维素酶发酵条件的优化[J]. 中南林业科技大学学报,2010, 09:30(9): 112-119.
- [14] 赵志慧. 中国禾本科作物上镰孢菌属真菌分类的研究[D]. 沈阳:沈阳农业大学,2008.
- [1] Wood W A, Kellogg S T. Cellulose and Hemicellulose[J].Methods in Enzymology. Biomass. Part A, 1988, 160.
中南林业科技大学学报
